前言
工作了20年,终于把检验科的管理体系弄明白了。
今天,我也制作成了这个视频,希望对您有一定帮助,尤其是准备ISO15189的实验室。
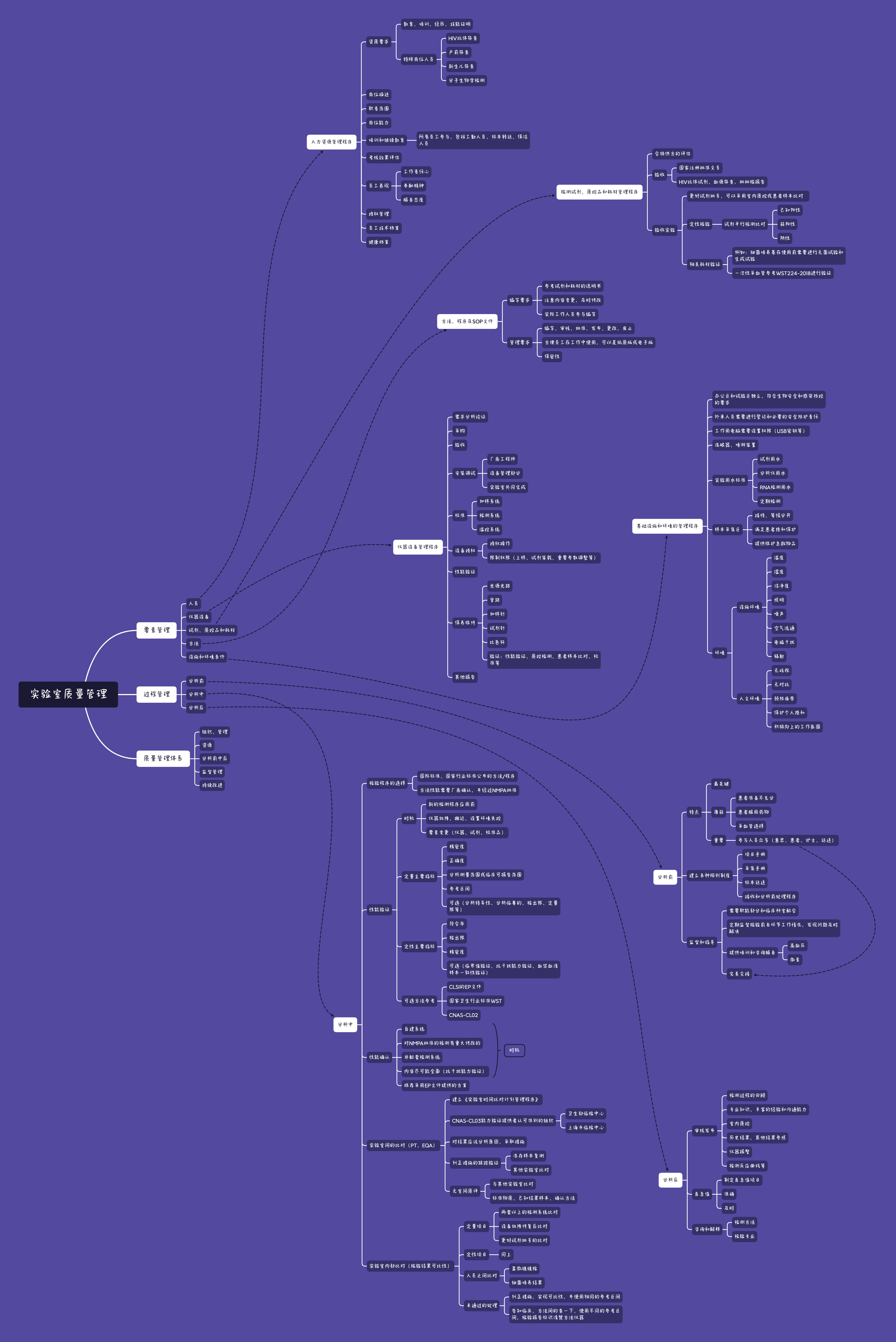
检验科的管理体系,如果按CNAS的要素划分,可以分为15个管理要素,和10个技术要素。
用简单的常用的划分方式可以分为:人、机、料、法、环。
即,人员,仪器,试剂,方法,环境。
人员管理
首先,我们来看人员管理。建立并实施人员资源管理程序,内容应包括:各级各类的人员资质要求,岗位描述,职责范围,继续教育,考核评估,授权,员工表现,员工技术档案,健康情况等。
人员资质,应包含教育、培训经历,技能证明等,对于一些特殊的岗位,应具有相关的上岗证明(例如,HIV抗体筛查、产前筛查、新生儿筛查、分子生物学检测等)
培训和能力评估,要对所有员工提供培训,包括工勤人员,标本转运、保洁人员。再根据岗位职责要求,评估员工培训后的能力。其外还应该对员工表现做评估,如工作责任心、奉献精神、服务态度、协作精神、组织纪律等。
仪器设备
仪器设备管理,首先,我们要建立《仪器设备管理程序》包括:需求分析,采购,验收,安装调试,校准,授权,性能验证,维护保养等。
安装调试是需要厂家、设备管理部门、实验室共同参与完成。
对于仪器的校准,我们应明确规定的周期,在更换重要部件,纠正失控等,对测量结果产生影响的情况下,都需要校准,内容至少包括:加样系统,检测系统,温控系统。
设备在使用前,需要进行性能验证,并授权给相应的经过培训的相关人员,可将控制权限进行划分,例如操作权限、设置仪器某些参数的权限等。
维修与保养,常见的内容有:光路系统,管路系统,加样针、试剂针、比色系统等。如果维修后可能影响检测结果,还应该进行质控验证、患者样本验证、或性能验证等。
试剂
试剂、质控品和耗材管理,应有国家注册批准文号,特殊项目还应有批批检报告,由指定人员负责验收、库存管理。
新批次的试剂使用前验收,可以采用室内质控或患者样本比对等方法。免疫定性项目,采用试剂平行试验(用已知的阳性、弱阳性和阴性)进行比对。
除了试剂,对影响检验质量的耗材,也需要在使用前进行验证,例如细菌培养基的无菌试验和生成实验,一次性采血管的验证。
方法/程序SOP的文件管理,各个专业组在编写SOP的时,需要参考试剂和耗材的说明书,对于内容变更部分,做到及时修改,这部分工作需要实际工作的一线人员共同参与编写。
SOP文件的管理,可以分为:编写、审核、批准、发布、更改、废止,为了方便使用,SOP应该采用纸质版或者电子版,对于未经许可的文件,不能复制和外传。
设施和环境
设施和环境,同样,也需要建立《基础设施与环境条件管理程序》,设置的办公区和试验区要相对独立,符合生物安全要求。
外来人员进入实验室内,需经过批准,并告知其防护责任。对工作用的电脑设置权限,保证医疗信息安全
洗眼器、喷淋装置,应安装在10s以内能到达的地方。
实验室用水,依据不同用途设置适宜的标准,例如:试剂用水,分析仪用水,分子检测用水等,并定期检测。
样本采集区,应将接待等候与标本采集区分开,同时要满足患者隐私,提供维护急救物品。
环境条件包括:温湿度、洁净度、照明、噪声、空气、电磁干扰、辐射等等,做好相应的规定和记录。
人文环境也同样重要,要营造一个无歧视、无对抗、积极向上的工作氛围,预防过度疲劳,保护个人隐私等。
按检验过程管理,可以分为分析前、分析中、分析后,
分析前
分析前是最关键的过程,如果开始就错了,那么后面一定是错误的。这一过程涉及到的人员多,包括医生、护士、患者、标本运送、物流系统、标本接收、前处理,内部交接过程,采集过程又涉及到患者准备、不同的采集管选择等很多内容。
所以在分析前,应建立各种规章制度,如:检验项目手册、采集手册、标本转运程序、接收和分析前处理程序等。其次,要对整个过程进行监督指导,大部分工作都是需要职能部门和临床科室的配合,定期的监督各环节的工作情况,发现问题后能及时解决。
科室也要提供相应的培训和咨询服务(例如:高血压、激素等标本的采集时机,抗凝剂的选择等)
尽可能的保证标本的所有过程做到完美交接。
分析中
分析中这一过程主要都是在检验科内部完成的,主要包括:检验程序的选择、性能验证、性能确认、室间比对、室内比对等。
检验程序的必须选择国际标准、国家行业标准、公认教科书、指南等权威的方法程序。其次,选择的方法性能经过厂商确认,并通过NMPA注册批准。
选择方法之后,在新的检验程序应用前;仪器故障维修、搬迁、环境改变;试剂、校准品等改变,都需要进行性能验证、
性能验证的主要指标可以分为定量项目和定性项目。定量的指标应包括:精密度、正确度、分析测量范围、临床可报告范围、参考区间等等。
定性的指标应该包括:符合率、检出限、精密度等等。具体的验证方法依据,可以是EP文件、WST文件,CNAS-CL02要求。
还有一种比较复杂的情况就是性能确认,它主要是针对自建系统、非配套检测系统,所以验证的内容应尽可能全面(除了上面的性能验证的项目外,还要包括抗干扰能力验证)推荐采用EP文件作为验证依据。
在检验过程中,还需要建立实施《实验室间比对计划管理程序》,我们参加的组织需通过CNAS-CL03《能力验证提供者认可准则》,当然也可以参加CAP组织的PT/EQA计划。
对于满意、或不满意的结果都要进行分析,执行纠正措施,识别潜在的不符合,主动寻求改进机会。
纠正后的跟踪验证,可以选择冻存样本或其他实验室比对。有一些无室间质评的项目,可以与其他实验室比对,尽量选择已获得认可的实验室、使用相同的检测方法的同级或高级别实验室。还可以选择标准物质或已知结果的患者样本进行比对验证。
完成了室间比对,如果实验室内有多个检测系统、不同的人员、不同的试剂批次,我们都需要进行实验室内部比对。
包括定量项目和定性项目,两台以上的检测系统比对,每年要进行2次,每次20分样本,允许品偏倚小于1/2TEA。
如果仪器故障,也需要在修复后进行比对,例如更换比色杯、灯泡、测量池等。
其次在新批号试剂应用前,也需要进行试剂间比对,采用5分样本,4份样本小于1/3TEA
内部比对还包括人员比对,例如显微镜检测、细菌培养等项目,每年应至少2次。
如果比对结果未通过,我们也经常会发生这种情况,可以采用纠正措施尽可能的实现检验结果具有可比性,并使用同样的参考区间。
如果实在无法通过,我们应将方法间的差异告知临床,明确标识不同的测量仪器、不同的参考区间。
分析后
分析后,我们需要对检验结果审核,并发布。
审核结果前,需要判断室内质控是否通过,也要考虑临床的病人资料、与其他检验结果的逻辑关系、仪器的报警、检测曲线等进行综合判断。这一环节是对检测过程的回顾和再次检查,要体现审核人员的专业知识和工作经验,同时应具有较强的临床沟通能力。
当然有一些特殊的结果,如危急值,要制定个性化的危急值项目和范围。确保危急值的结果准确,危急值报告及时。
当然在检验结果发布后,我们也要提供从检验方法和检验专业角度的咨询和解释。
做好检验质量管理体系,任重而道远,它包括了:组织、管理、人机料法环等资源、分析全过程、监督、持续改进等等。
我做的整个检验体系流程,仅仅是大体框架,任意一项都可以进行再细化,有些内容甚至也是涉及其他学科,而检验本身的子专业就很多,检验项目更是多达成百上千项,细分再细分后更是细思恐极。
在检验的体系上,以我微薄之力,在今年上半年,对人员,和性能验证,两部分都做了两款软件,细节满满,欢迎体验。
交流
为了方便同行交流,我也组建了一个小群,欢迎加入。我是检验大叔,今天的分享就到这里,我们下期见。
